Üçlü nokta
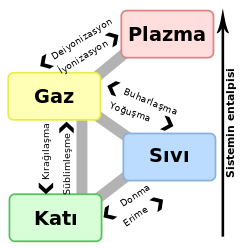
Üçlü nokta, termodinamikte bir maddenin üç fazının (gaz, sıvı ve katı) termodinamik dengede bir arada var olduğu sıcaklık ve basınçtır. Süblimleşme eğrisi, erime eğrisi ve buharlaşma eğrisi bu noktada buluşurlar.[1]
Katı, sıvı ve gaz fazlarına ek olarak, üçlü noktada birden fazla katı faz bulunabilir. Helyum-4, iki farklı sıvı fazı içeren bir üçlü noktaya sahip olan özel bir durumdur (lambda noktası).[1]
Suyun üçlü noktası, Uluslararası Birimler Sisteminde (SI) termodinamik sıcaklığın temel birimi olan kelvini tanımlamak için kullanılıyordu.[2] Suyun üçlü noktasının değeri ölçülmek yerine tanımlanarak sabitlenmişti, ancak bu durum SI temel birimlerinin 2019 yılında yeniden tanımlanmasıyla değişti. ITS-90 uluslararası sıcaklık ölçeğinde hidrojenin üçlü noktasından (13.8033 K) suyun üçlü noktasına (273.16 K, 0.01 °C veya 32.018 °F) kadar değişen birden fazla maddenin üçlü noktası kullanılır.
"Üçlü nokta" terimi, ilk olarak 1873 yılında William Thomson'ın kardeşi James Thomson tarafından kullanıldı.[3]
Üçlü nokta tablosu
[değiştir | kaynağı değiştir]Bu tablo çeşitli maddelerin üçlü noktalarını listeler. Veriler, ABD Ulusal Standartlar ve Teknoloji Enstitüsü'nden gelmektedir.
| Substance | T [K] (°C) | p [kPa]* (atm) |
|---|---|---|
| Asetilen | 192,4 K (-80,6 °C; -113,08 °F) | 120 kPa (1,2 atm) |
| Amonyak | 195,40 K (-77,6 °C; -107,68 °F) | 6,060 kPa (0,05981 atm) |
| Argon | 83,81 K (-189,19 °C; -308,542 °F) | 68,9 kPa (0,680 atm) |
| Arsenik | 1090 K (817 °C; 1502,6 °F) | 3.628 kPa (35,81 atm) |
| Bütan | 134,6 K (-138,4 °C; -217,12 °F) | 7×10-4 kPa (6,9×10-6 atm) |
| Karbon (grafit) | 4765 K (4492 °C; 8117,6 °F) | 10.132 kPa (100,00 atm) |
| Karbondioksit | 216,55 K (-56,45 °C; -69,61 °F) | 517 kPa (5,10 atm) |
| Karbonmonoksit | 68,10 K (-204,9 °C; -336,82 °F) | 15,37 kPa (0,1517 atm) |
| Kloroform | 175,43 K (-97,57 °C; -143,626 °F) | 0,870 kPa (0,00859 atm) |
| Döteryum | 18,63 K (-254,37 °C; -425,866 °F) | 17,1 kPa (0,169 atm) |
| Etan | 89,89 K (-183,11 °C; -297,598 °F) | 8×10-4 kPa (7,9×10-6 atm) |
| Etanol | 150 K (-123 °C; -189,4 °F) | 4,3×10-7 kPa (4,2×10-9 atm) |
| Etilen | 104,0 K (-169 °C; -272,2 °F) | 0,12 kPa (0,0012 atm) |
| Formik asit | 281,40 K (8,4 °C; 47,12 °F) | 2,2 kPa (0,022 atm) |
| Helyum-4 (lambda noktası)[4] | 2,1768 K (-270,8232 °C; -455,48176 °F) | 5,048 kPa (0,04982 atm) |
| Heksafloroetan | 173,08 K (-99,92 °C; -147,856 °F) | 26,60 kPa (0,2625 atm) |
| Hidrojen | 13,84 K (-259,16 °C; -434,488 °F) | 7,04 kPa (0,0695 atm) |
| Hidrojen klorür | 158,96 K (-114,04 °C; -173,272 °F) | 13,9 kPa (0,137 atm) |
| İyot[5] | 386,65 K (113,65 °C; 236,57 °F) | 12,07 kPa (0,1191 atm) |
| İzobütan | 113,55 K (-159,45 °C; -255,01 °F) | 1,9481×10-5 kPa (1,9226×10-7 atm) |
| Kripton | 115,76 K (-157,24 °C; -251,032 °F) | 74,12 kPa (0,7315 atm) |
| Cıva | 234,2 K (-38,8 °C; -37,84 °F) | 1,65×10-7 kPa (1,63×10-9 atm) |
| Metan | 90,68 K (-182,32 °C; -296,176 °F) | 11,7 kPa (0,115 atm) |
| Neon | 24,57 K (-248,43 °C; -415,174 °F) | 43,2 kPa (0,426 atm) |
| Azot oksit | 109,50 K (-163,5 °C; -262,3 °F) | 21,92 kPa (0,2163 atm) |
| Azot | 63,18 K (-209,82 °C; -345,676 °F) | 12,6 kPa (0,124 atm) |
| Nitröz oksit | 182,34 K (-90,66 °C; -131,188 °F) | 87,85 kPa (0,8670 atm) |
| Oksijen | 54,36 K (-218,64 °C; -361,552 °F) | 0,152 kPa (0,00150 atm) |
| Paladyum | 1825 K (1552 °C; 2825,6 °F) | 3,5×10-3 kPa (3,5×10-5 atm) |
| Platin | 2045 K (1772 °C; 3221,6 °F) | 2×10-4 kPa (2,0×10-6 atm) |
| Radon | 202 K (-71 °C; -95,8 °F) | 70 kPa (0,69 atm) |
| Silan[6] | 88,48 K (-184,52 °C; -300,136 °F) | 0,019644 kPa (0,00019387 atm) |
| Kükürt dioksit | 197,69 K (-75,31 °C; -103,558 °F) | 1,67 kPa (0,0165 atm) |
| Titanyum | 1941 K (1668 °C; 3034,4 °F) | 53×10-3 kPa (5,2×10-4 atm) |
| Uranyum hexaflorür | 337,17 K (64,17 °C; 147,506 °F) | 151,7 kPa (1,497 atm) |
| Su[7][8] | 273,16 K (0,16000000000003 °C; 32,288 °F) | 0,611657 kPa (0,00603659 atm) |
| Ksenon | 161,3 K (-111,7 °C; -169,06 °F) | 81,5 kPa (0,804 atm) |
| Çinko | 692,65 K (419,65 °C; 787,37 °F) | 0,065 kPa (0,00064 atm) |
* Not: Normal şartlar altında, atmosferik basınç 101.325 kPa'dır. (1 atm)
Ayrıca bakınız
[değiştir | kaynağı değiştir]Kaynakça
[değiştir | kaynağı değiştir]- ^ a b IUPAC, Compendium of Chemical Terminology, 2. basım (the "Gold Book") (1997). Düzeltilmiş çevrimiçi sürümü: (1994) "Triple point"..
- ^ Definition of the kelvin 16 Temmuz 2012 tarihinde Wayback Machine sitesinde arşivlendi. at BIPM.
- ^ James Thomson (1873) "A quantitative investigation of certain relations between the gaseous, the liquid, and the solid states of water-substance" 5 Aralık 2021 tarihinde Wayback Machine sitesinde arşivlendi., Proceedings of the Royal Society, 22 : 27–36. From a footnote on page 28: " … the three curves would meet or cross each other in one point, which I have called the triple point".
- ^ Donnelly, Russell J.; Barenghi, Carlo F. (1998). "The Observed Properties of Liquid Helium at the Saturated Vapor Pressure". Journal of Physical and Chemical Reference Data. 27 (6). ss. 1217-1274. Bibcode:1998JPCRD..27.1217D. doi:10.1063/1.556028.
- ^ Walas, S. M. (1990). Chemical Process Equipment – Selection and Design. Amsterdam: Elsevier. s. 639. ISBN 0-7506-7510-1.
- ^ "Silane-Gas Encyclopedia". Gas Encyclopedia. Air liquide. 13 Nisan 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Ocak 2026.
- ^ International Equations for the Pressure along the Melting and along the Sublimation Curve of Ordinary Water Substance 3 Haziran 2016 tarihinde Wayback Machine sitesinde arşivlendi.. W. Wagner, A. Saul and A. Pruss (1994), J. Phys. Chem. Ref. Data, 23, 515.
- ^ Murphy, D. M. (2005). "Review of the vapour pressures of ice and supercooled water for atmospheric applications" (PDF). Quarterly Journal of the Royal Meteorological Society. 131 (608). ss. 1539-1565. Bibcode:2005QJRMS.131.1539M. doi:10.1256/qj.04.94. 16 Ocak 2020 tarihinde kaynağından arşivlendi (PDF)20 Mayıs 2020.
Dış bağlantılar
[değiştir | kaynağı değiştir] Wikimedia Commons'ta üçlü nokta ile ilgili çoklu ortam belgeleri bulunur
Wikimedia Commons'ta üçlü nokta ile ilgili çoklu ortam belgeleri bulunur